Оксид хрома(IV) — неорганическое соединение, оксид металла хрома с формулой CrO2, чёрные кристаллы, не растворимые в воде.
| Оксид хрома(IV) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
оксид хрома(IV) |
| Традиционные названия | диоксид хрома, двуокись хрома |
| Хим. формула | CrO2 |
| Физические свойства | |
| Состояние | чёрные кристаллы |
| Молярная масса | 83,99 г/моль |
| Плотность | 4,95 г/см³ |
| Термические свойства | |
| Энтальпия | |
| • образования | -588,3 кДж/моль |
| Классификация | |
| Рег. номер CAS | 12018-01-8 |
| PubChem | 73415796 |
| Рег. номер EINECS | 234-630-4 |
| SMILES | |
| InChI | |
| RTECS | GB6400000 |
| ChEBI | CHEBI:48263 |
| ChemSpider | 34987119 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
править- Нагревание гидратированного оксида хрома(III) в кислороде:
- Разложение нитрата хрома(III) при нагревании:
Физические свойства
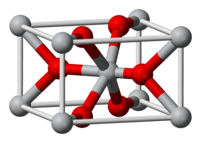
правитьОксид хрома(IV) образует чёрные кристаллы тетрагональной сингонии, пространственная группа P 42/mcc, параметры ячейки a = 0,4422 нм, c = 0,2918 нм, Z = 2.
Ферромагнетик, обладает металлической проводимостью, при 110°С переходит в парамагнитное состояние.
Не растворяется в воде.
Образует гидраты состава 2CrO2•H2O, 2CrO2•3H2O, CrO2•2H2O, 3CrO2•7H2O.
Химические свойства
править- Разлагается при нагревании:
- При длительном кипячении реагирует с водой:
- или
- Окисляет соляную кислоту:
Применение
править- Как рабочее вещество в носителях магнитной записи.
Литература
править- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |