Карбонѝлсульфи́д (оксид-сульфид углерода(IV)) — химическое соединение, смешанный оксид-сульфид углерода с формулой . Структура молекулы линейна, аналогична структуре и при этом все три молекулы изоэлектронны друг другу. Карбонилсульфид можно считать промежуточным соединением между диоксидом углерода и сероуглеродом.
| Карбонилсульфид | |
|---|---|
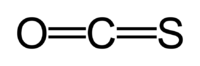 | |
| Общие | |
| Систематическое наименование |
Оксид-сульфид углерода(IV) |
| Традиционные названия | Карбонилсульфид |
| Хим. формула | |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 60,075 г/моль |
| Энергия ионизации | 11,17 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | −138,8 °C |
| • кипения | −50,2 °C |
| Структура | |
| Дипольный момент | 2,4E−30 Кл·м[1] |
| Классификация | |
| Рег. номер CAS | 463-58-1 |
| PubChem | 10039 |
| Рег. номер EINECS | 207-340-0 |
| SMILES | |
| InChI | |
| ChEBI | 16573 |
| ChemSpider | 9644 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
При нормальных условиях — бесцветный легковоспламеняющийся газ с неприятным запахом.
История открытия
правитьКарбонилсульфид был обнаружен впервые в 1841 году, хотя и был описан как смесь диоксида углерода и сероводорода. Только к 1867 году карбонилсульфид был описан как индивидуальное вещество венгерским химиком Карлом фон Таном.
Получение
правитьПростейший способ синтеза карбонилсульфида — взаимодействие угарного газа с плавленой серой при 350 °С на угольном катализаторе[2]:
- .
Другой способ — реакция роданида калия с серной кислотой, в процессе которой выделяется много карбонилсульфида, но при этом образуются и другие побочные продукты реакции (синильная кислота, водяной пар и сероуглерод):
- .
Гидролиз изотиоцианатов в соляной кислоте также образует карбонилсульфид.
Химические свойства
правитьКарбонилсульфид легко гидролизуется, особенно в присутствии катализатора — солей хрома:
- .
Токсичность
правитьВысокие концентрации карбонилсульфида в воздухе (более 1000 частей на миллион) могут вызвать внезапный коллапс, судороги и смерть от паралича дыхания[3][4]. Сообщалось о редких смертельных случаях, практически без местного раздражения или обонятельного предупреждения. В ходе испытаний на крысах 50 % животных погибли при воздействии 1400 частей на миллион карбонилсульфида в воздухе в течение 90 минут или при 3000 частей на миллион в течение 9 минут[4].
Примечания
править- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. — М., 2007. — С. 101. — 162 с. Архивировано 11 мая 2023 года.
- ↑ Carbonyl Sulfide CASRN: 463-58-1. Hazardous Substances Data Bank. National Library of Medicine. Дата обращения: 11 октября 2023. Архивировано 29 февраля 2020 года.
- ↑ 1 2 Chemical Summary for Carbonyl Sulfide. U.S. Environmental Protection Agency (19 июля 2013). Дата обращения: 11 октября 2023. Архивировано 24 сентября 2015 года.



