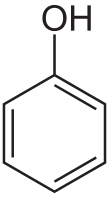
Фено́л (гидро́ксибензо́л, устар. «карбо́ловая кислота́», химическая формула — C6H6O или C6H5OH) — органическое соединение, возглавляющее класс фенолов.
| Фенол | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Гидроксибензол | ||
| Традиционные названия | Фенол, карболовая кислота, бензоло́л; оксибензо́л | ||
| Хим. формула | C6H6O | ||
| Рац. формула | C6H5OH | ||
| Физические свойства | |||
| Состояние | Твёрдое | ||
| Молярная масса | 94,11 г/моль | ||
| Плотность | 1,07 г/см³ | ||
| Энергия ионизации | 8,5 ± 0,1 эВ и 8,47 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 41 °C | ||
| • кипения | 181,84 °C | ||
| • вспышки | 79 (в закрытом тигле), 85 (в открытом) °C | ||
| Пределы взрываемости | 1,8 ± 0,1 об.% | ||
| Мол. теплоёмк. | 134,7 (кр.) Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −162,944 кДж/моль | ||
| Давление пара | 0,4 ± 0,1 мм рт.ст. | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9,89 ± 0,01[2] | ||
| Растворимость | |||
| • в воде | 6,5 г/100 мл | ||
| Структура | |||
| Гибридизация | sp2-гибридизация | ||
| Дипольный момент | 4,1E−30 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 108-95-2 | ||
| PubChem | 996 и 20488062 | ||
| Рег. номер EINECS | 203-632-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | SJ3325000 | ||
| ChEBI | 15882 | ||
| Номер ООН | 1671 | ||
| ChemSpider | 971 | ||
| Безопасность | |||
| ЛД50 | 140 мг/кг (морская свинка, внутрижелудочно) | ||
| Токсичность | Токсичен, весьма едкий, является сильным ирритантом | ||
| Фразы риска (R) | R23/24/25, R34, R48/20/21/22, R68 | ||
| Фразы безопасности (S) | S24/25, S26, S28, S36/37/39, S45 | ||
| Краткие характер. опасности (H) |
H301, H311, H331, H314, H341, H373 |
||
| Меры предостор. (P) |
P260, P301+P310, P303+P361+P353, P305+P351+P338, P361, P405, P501 |
||
| Сигнальное слово | опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||


При стандартных условиях фенол — это бесцветные игольчатые кристаллы, розовеющие на воздухе, с характерным запахом. Токсичен, является сильным ирритантом.
История
правитьФенол был обнаружен в 1834 году Фридлибом Фердинандом Рунге, который извлёк его (в нечистом виде) из каменноугольной смолы[3]. Рунге назвал фенол «Karbolsäure» (угольно-масляная кислота, карболовая кислота). Каменноугольная смола оставалась основным источником получения фенола до развития нефтехимической промышленности. В 1841 году французский химик Огюст Лоран получил фенол в чистом виде[4].
В 1836 году Огюст Лоран придумал название «фен» для бензола[5], это корень слов «фенол» и «фенил». В 1843 году французский химик Шарль Герхардт придумал название «фенол»[6].
Антисептические свойства фенола конце 1870-х использовал и пропагандировал Склифосовский Николай Васильевич (1836—1904) — русский профессор медицины, военный врач-хирург. В то время, как во многих странах Европы, внедрение антисептики встречало сильное сопротивление и критику со стороны медицинского сообщества. Н. В. Склифосовскому, благодаря его авторитету, удалось сломить это сопротивление сначала в Москве, а затем и во всей Российской империи.
Сэр Джозеф Листер (1827—1912) использовал фенол в своей пионерской технике антисептической хирургии. Листер решил, что сами раны должны быть тщательно очищены. Затем он покрыл раны кусочком тряпки или ворса[7], покрытого фенолом или «карболовой кислотой», как он её называл. Раздражение кожи, вызванное постоянным воздействием фенола, в конечном итоге привело к внедрению асептических методов в хирургию.
Физические свойства
правитьПредставляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов). Обладает специфическим запахом (таким, как запах гуаши, так как входит в его состав). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5%-й раствор в воде — антисептик, широко применявшийся в медицине в прошлом.
Химические свойства
правитьИз-за наличия ароматического кольца и гидроксильной группы фенол проявляет химические свойства, характерные как для спиртов, так и для ароматических углеводородов.
По гидроксильной группе:
- Обладает слабыми кислотными свойствами (более сильными, чем у спиртов), при действии щелочей образует соли — феноляты (например, фенолят натрия — C6H5ONa)[8]:
Фенол — настолько слабая кислота, что даже угольная кислота вытесняет его из фенолятов:
Более интенсивно феноляты разлагаются под действием сильных кислот, например, под действием серной кислоты:
Взаимодействие с металлическим натрием:
Фенол непосредственно не этерифицируется карбоновыми кислотами, эфиры можно получить при взаимодействии фенолятов с ангидридами или галогенангидридами кислот:
Образование простых эфиров. Для получения простых эфиров фенола действуют галогеналканами или галогенпроизводными аренов на феноляты. В первом случае получают смешанные жирно-ароматические простые эфиры:
Во втором случае получают чисто-ароматические простые эфиры:
Реакция проводится в присутствии порошкообразной меди, которая служит катализатором.
При перегонке фенола с цинковой пылью происходит замещение гидроксильной группы водородом[9]:
Фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Гидроксогруппа, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения[10]. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
Взаимодействие с бромной водой (качественная реакция на фенол):
Образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
Взаимодействие с концентрированной азотной кислотой:
Взаимодействие с хлоридом железа(III) (качественная реакция на фенол[11]):
Реакция присоединения: гидрирование фенола в присутствии металлических катализаторов приводит к образованию циклогексанола и циклогексанона:
Окисление фенола: вследствие наличия гидроксильной группы в молекуле фенола устойчивость к окислению намного ниже, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты. Так, под действием пероксида водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Получение
правитьИсторически первыми промышленными методами получения фенола были методы, основанные на замещении водорода в бензоле на сульфогруппу или хлор с последующим щелочным гидролизом до фенола, однако в настоящее время эти методы вытеснены методами, в которых используется окисление углеводородного сырья кислородом воздуха - кумольным и толуольными процессами.
В настоящее время основная часть производства фенола в промышленном масштабе осуществляется кумольным методом.
Сульфонатный процесс
правитьСульфонатный процесс - исторически первый метод промышленного синтеза фенола, первое производство этим методом было запущено BASF в 1899 г. Процесс осуществляется в три стадии: на первой проводят сульфирование бензола с образованием бензолсульфокислоты, на второй - бензолсульфокислоту переводят в натриевую соль и сплавляют с едким натром при температуре 285-315 °C, в результате чего образуется cплав из сульфита и фенолята натрия, на третьей - плав подкисляют для выделения фенола из фенолята. :
- C6H6 + H2SO4 C6H5SO3H
Для получения натриевой соли бензолсульфокислоты на втором этапе используют сульфит натрия, образующийся при щелочном плавлении и выделении фенола из фенолята в щелочном плаве, при этом выделяется SO2:
- 2 C6H5SO3H + Na2SO3 2 C6H5SO3Na + SO2 + H2O
после чего сплавляют бензолсульфонат натрия с едким натром:
- C6H5SO3Na + NaOH C6H5ONa + Na2SO3
Выделение фенола из фенолята проводят обработкой раствора плава SO2, полученного при переводе бензолсульфокислоты в натриевую соль:
- 2 C6H5ONa + SO2 + H2O 2 C6H5OH + Na2SO3
Недостатком сульфонатного процесса является образование побочных продуктов при сульфировании бензола (дифенилсульфона, m-дисульфокислоты) и при щелочном плавлении (дифениловый эфир и т.п.), большого (несмотря на повторное использования сульфита натрия) количества отходов и высокая себестоимость. Несмотря на эти недостатки, процесс использовался в течение 80 лет, в США последнее производство, основанное на сульфонатном процессе, было закрыто в 1978 г[12].
Хлорбензольный метод и процесс Рашига
правитьМетод получения фенола хлорированием бензола с последующим гидролизом хлорбензола был разработан в США компанией Dow Chemical в 1924 г. и, примерно в это же время в Германии компанией I.G. Farbenindustrie.
В первоначальном варианте метод давал в качестве побочного продукта большое количество хлороводорода, эта проблема была решена в 1930 г. Рашигом и реализована в процессе Рашига-Хукера, в котором синтез хлорбензола проводят окислительным хлорированием бензола хлороводородом, возвращаемым в установку хлорирования из гидролизной установки:
Окислительным хлорирование проводят при температуре 250-270 °C над катализатором - оксидом алюминия, активированного хлоридом меди.
Гидролиз хлорбензола проводят водяным паром при температурах 400-500 °C в присутствии катализатора - фосфата кальция, активированного медью.
Преимуществом процесса Рашига-Хукера является высокий выход фенола в пересчете на бензол - 80-85 масс. %, недостатком - агрессивная среда (HCl и Cl2) при высоких температурах и сложность аппаратурно-технологического оформления, что обуславливает высокую себестоимость производимого фенола[12].
Окисление толуола
правитьВ начале 1960-х компанией Dow Chemical of Canada был разработан процесс синтеза фенола окислением толуола с суммарным уравнением[13]:
Процесс проходит в две стадии: сначала толуол окисляется до бензойной кислоты, а затем бензойная кислота подвергается окислительному декарбоксилированию до фенола, обе реакции проводят в жидкой фазе.
Окисление толуола до бензойной кислоты кислородом воздуха для производства бензойной кислоты начало использоваться в 1940-х в Германии[12], в настоящее время процесс проводят в присутствии катализатора - растворимого в толуоле нафтената кобальта, реакцию проводят при 100–150 °C и давлении ~3 бар[14]:
Окислительное декарбоксилирование бензойной кислоты до фенола проводят при атмосферном давлении 230–240 °C в расплаве бензойной кислоты, в качестве катализатора используется бензоат меди (II)[14], выход составляет ~82%[12].
Реакция проходит в три стадии, на первой стадии из бензойной кислоты образуется фенилсалицилат:
Затем фенилсалицилат in situ гидролизуется до салициловой кислоты и бензойной кислоты:
На последней стадии салициловая кислота декарбоксилируется до фенола:
Кумольный метод
правитьМетод был независимо и практически одновременно разработан группой советских заключенных (П. Г. Сергеев, Р. Ю. Удрис, Б. Д. Кружалов), работавших в ОКБ тюремного типа и немецким химиком Генрихом Хоком в 1940-х[12],[15].
Метод основан на окислении кумола воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
В промышленности используется несколько методов окисления кумола:
- Окисление в водной эмульсии, в которую добавляются эмульгаторы и щелочь до pH 8.5-10.5, чтобы предотвратить разложение гидропероксида побочно образующимися при окислении карбоновыми кислотами;
- Гомогенное окисление при 100–130 °С и 4-6 атм.
Гидропероксид извлекается из реакционной смеси либо вакуумной перегонкой, при которой из нее отгоняются кумол и вода, при этом гидропероксид остается в кубовом остатке, либо экстракцией едким натром с образованием малорастворимой натриевой соли.
Щелочная экстракция дает продукт с содержанием натриевой соли гидропероксида в 97-98%, который разлагается серной кислотой почти без образования побочных продуктов.
Разложении гидропероксида серной кислотой проводят при 50-60°С и концентрации кислоты 0.1-1% от массы гидропероксида. Этот процесс ведет к образованию ряда побочных продуктов (диметилфенилкарбинол, ацетофенон и т.д.), которые в условиях реакции образуют смолообразные отходы (фенольная смола).
Благодаря доступности исходного сырья — кумол легко синтезируется из бензола и пропилена — 95 % всего производимого в мире фенола производят этим методом.
По сравнению с большинством других процессов, процесс кумола использует относительно мягкие условия синтеза и относительно недорогое сырьё. Однако, чтобы работать экономно, должен быть спрос как на фенол, так и на ацетон[16][17]: В 2010 году мировой спрос на ацетон составлял примерно 6,7 миллиона тонн, 83% из которых были удовлетворены ацетоном, полученным кумольным методом;
- окисление толуола, с промежуточным образованием бензойной кислоты (около 3 %);
- выделением из каменноугольной смолы.
Биологическая роль
правитьПротеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает фермент тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. В чистом виде фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
правитьМировое производство фенола на 2006 год составляет 8,3 млн т/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ[источник не указан 2225 дней]. По данным на 2006 год мировое потребление фенола имеет следующую структуру:
- 43 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбонатов и эпоксидных смол;
- 30 % фенола расходуется на производство фенолформальдегидных смол;
- 12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона[18];
- в России большое количество фенола используется в нефтепереработке, в частности, для селективной очистки масел на технологических установках типа 37/1 и А-37/1. Фенол проявляет высокую селективность и эффективность при удалении из масел смолистых веществ, различных полициклических ароматических углеводородов с короткими боковыми цепями, а также соединений, содержащих серу[19];
- остальной фенол расходуется на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство[20].
Фенол и его производные обусловливают консервирующие свойства коптильного дыма. В косметологии — как химический пилинг (токсично).
- в скотоводстве — дезинфекция животных растворами фенола и его производных.
- в косметологии — для проведения глубокого пилинга.
Токсические свойства
правитьФенол — токсичное вещество. По степени воздействия на человеческий организм фенол относится к высокоопасным веществам (Класс опасности 2). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют[21].
Предельно допустимые концентрации (ПДК) фенола[22][23][24][25]:
- ПДКр.з. = 1 мг/м³ (2 класс опасности)
- ПДКр.с. = 0,3 мг/м³ (2 класс опасности)
- ПДКм.р. = 0,01 мг/м³
- ПДКс.с. = 0,006 мг/м³
- ПДКв. = 0,001 мг/л.
Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом — паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь — 1—10 г, для детей — 0,05—0,5 г[26].
Охрана труда
правитьПДК в воздухе рабочей зоны — 1 мг/м³ (максимально разовая) и 0,3 мг/м³ (среднесменная)[23]. Порог восприятия запаха фенола может достигать (среднее значение в группе) 5,8-7,5 мг/м³[27], у отдельных работников он может быть значительно больше среднего значения.
Фенольная катастрофа в Уфе
правитьМасштабный случай загрязнения окружающей среды фенолом произошёл весной 1990 года в окрестностях города Уфы. В результате техногенной аварии на предприятии ПО «Уфахимпром» произошла утечка большого количества фенола в ручей Чернушка и далее через реку Шугуровку в реку Уфу, являющуюся источником хозяйственно-питьевого водоснабжения города Уфы. Содержание фенола в водах Уфы в районе Южного водозабора превысило ПДК более чем в 100 раз, а в реке Шугуровке — более чем в 100 тыс. раз. Негативную роль играло также обеззараживание водопроводной воды хлором, при взаимодействии с которым фенол даёт хлорпроизводные — более токсичные вещества (некоторые в 100—250 раз превышают токсичность самого фенола)[нет в источнике]. Общая численность населения, потреблявшего загрязнённую питьевую воду из Южного водозабора Уфы, составила 672 876 человек. Население Уфы было оповещено об опасности употребления водопроводной воды для питья. Был организован подвоз чистой воды. В течение месяца до нормализации состава питьевой воды с Южного водозабора за медицинской помощью обратилось около 3 тысяч жителей Уфы, 248 из них было госпитализировано, однако случаев отравления фенолом комиссия Минздрава Башкирии не выявила[28].
Примечания
править- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Binas (нидерл.) — 2 — Noordhoff Uitgevers, 1986. — ISBN 978-90-01-89351-4
- ↑ F. F. Runge (1834) «Ueber einige Produkte der Steinkohlendestillation» Архивная копия от 29 апреля 2021 на Wayback Machine (On some products of coal distillation), Annalen der Physik und Chemie, 31: 65-78. On page 69 of volume 31, Runge names phenol «Karbolsäure» (coal-oil-acid, carbolic acid). Runge characterizes phenol in: F. F. Runge (1834) "Ueber einige Produkte der Steinkohlendestillation, " Архивная копия от 3 марта 2021 на Wayback Machine Annalen der Physik und Chemie, 31: 308—328.
- ↑ Auguste Laurent (1841) «Mémoire sur le phényle et ses dérivés» Архивная копия от 27 октября 2019 на Wayback Machine (Memoir on benzene and its derivatives), Annales de Chimie et de Physique, series 3, 3: 195—228. On page 198, Laurent names phenol «hydrate de phényle» and «l’acide phénique».
- ↑ Auguste Laurent (1836) "Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique, " Annales de Chemie et de Physique, vol. 63, pp. 27-45, see p. 44 Архивная копия от 20 марта 2015 на Wayback Machine: Je donne le nom de phène au radical fondamental des acides précédens (φαινω, j'éclaire), puisque la benzine se trouve dans le gaz de l'éclairage. (I give the name of «phène» (φαινω, I illuminate) to the fundamental radical of the preceding acid, because benzene is found in illuminating gas.)
- ↑ Gerhardt, Charles (1843) "Recherches sur la salicine, " Архивная копия от 6 ноября 2018 на Wayback Machine Annales de Chimie et de Physique, series 3, 7: 215—229. Gerhardt coins the name «phénol» on page 221.
- ↑ Lister, Joseph. Antiseptic Principle Of The Practice Of Surgery (англ.). — 1867. Архивировано 15 сентября 2014 года.
- ↑ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1, Архивировано из оригинала 24 декабря 2019, Дата обращения: 27 октября 2019
- ↑ Roscoe, Henry. A treatise on chemistry, Volume 3, Part 3 (англ.). — London: Macmillan & Co., 1891. — P. 23.
- ↑ Organic Chemistry 2nd Ed. John McMurry ISBN 0-534-07968-7
- ↑ Качественная реакция на фенол Архивная копия от 31 мая 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ 1 2 3 4 5 Е.А. Ананьева, Е.В. Егорова, Л.В. Ларин. Современное состояние и перспективы процессов получения фенола. I. Обзор рынка и современное состояние процессов получения фенола. «Вестник МИТХТ», 2007, т. 2, № 2. Дата обращения: 26 марта 2024. Архивировано 15 сентября 2024 года.
- ↑ Kaeding, W. W.; Lindblom, R. O.; Temple, R. G.; Mahon, H. I. Oxidation of Toluene and Other Alkylated Aromatic Hydrocarbons to Benzoic Acids and Phenols. ACS Publications (1 мая 2002). Дата обращения: 27 марта 2024. Архивировано 27 марта 2024 года.
- ↑ 1 2 Wade, Leroy G. Organic Chemistry. — Pearson new international. — Harlow : Pearson Education Limited, 2014. — P. 985. — ISBN 978-1-292-02165-2.
- ↑ Hock, Heinrich; Lang, Shon (1944). "Autoxydation von Kohlenwasserstoffen, IX. Mitteil.: Über Peroxyde von Benzol-Derivaten". Berichte der deutschen chemischen Gesellschaft (A and B Series). 77 (3–4): 257—264. doi:10.1002/cber.19440770321. ISSN 1099-0682. Дата обращения: 26 марта 2024.
- ↑ Phenol -- The essential chemical industry online (11 января 2017). Дата обращения: 2 января 2018. Архивировано 3 января 2018 года.
- ↑ Direct Routes to Phenol. Дата обращения: 9 апреля 2007. Архивировано из оригинала 9 апреля 2007 года.
- ↑ Plotkin, Jeffrey S. What's New in Phenol Production? American Chemical Society (21 марта 2016). Дата обращения: 2 января 2018. Архивировано из оригинала 27 октября 2019 года.
- ↑ Яушев Р. Г., Усманов Р. М. Интенсификация процесса селективной очистки масел фенолом. — М.: ЦНИИТЭнефтехим, 1988. — 76 с. — (Переработка нефти).
- ↑ Phenol spray. drugs.com. Дата обращения: 27 октября 2019. Архивировано 11 июля 2017 года.
- ↑ U.S. Department of Health and Human Services. «How can phenol affect my health?» Архивная копия от 28 июня 2013 на Wayback Machine Toxicological Profile for Phenol: 24.
- ↑ s:Гигиенические нормативы ГН 2.2.5.1313—03. «Предельно допустимые концентрации (ПДК) вредных веществ воздухе рабочей зоны»
- ↑ 1 2 (Роспотребнадзор). № 535. Гидроксибензол (фенол) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — М., 2018. — С. 39. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ s:Гигиенические нормативы ГН 2.1.6.1338—03. «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест»
- ↑ s:Гигиенические нормативы ГН 2.1.5.1315—03. «Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования»
- ↑ Неотложная помощь при острых отравлениях. Справочник по токсикологии. Под ред. Голикова С. Н. — М.: Медицина, 1977. — С. 174.
- ↑ Herbert Kohler und Willem Jan Homans. Kombination von Olfactometer und Flammenionisationsdetektor zur Bestimmung von Geruchsschweilwerten – Einsatz der mcBmethodik in der Praxis (нем.) // Staub, Reinhaltung der Luft. — Düsseldorf: VDI-Verlag GmbH, 1980. — August (Bd. 40, H. 8). — S. 331—335. — ISSN 0039-0771.
- ↑ 1990 год — загрязнение питьевой воды г. Уфы фенолом Архивировано 15 января 2005 года.
Источники
правитьДополнительные
править- Волкова 3. А. (гиг.), Муратов В. К. (фарм.), Проказова Н. В. (биохим.). Фенолы // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1985. — Т. 26 : Углекислые воды. — С. 256—258. — 560 с. : ил.