Окси́д о́лова(IV) (диокси́д олова, двуо́кись олова, касситерит) — бинарное неорганическое соединение, оксид металла олова с формулой SnO2. Белые кристаллы, нерастворимые в воде.
| Оксид олова(IV) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Оксид олова(IV) |
| Традиционные названия | Окись олова, двуокись олова, диоксид олова; касситерит |
| Хим. формула | SnO2 |
| Рац. формула | SnO2 |
| Физические свойства | |
| Состояние | белые кристаллы |
| Молярная масса | 150,71 г/моль |
| Плотность | 7,0096 г/см3[1] |
| Термические свойства | |
| Температура | |
| • плавления | 1630 °C[1] |
| • кипения | 2500 (разл.)[1] °C |
| • разложения | − |
| Мол. теплоёмк. | 53,2[1] Дж/(моль·К) |
| Энтальпия | |
| • образования | −577,63[1] кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[3] |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворим |
| Оптические свойства | |
| Показатель преломления | 2,006 (D-линия натрия 589,29 нм)[2] |
| Структура | |
| Кристаллическая структура | тетрагональная типа рутила |
| Классификация | |
| Рег. номер CAS | 18282-10-5 |
| PubChem | 29011 |
| Рег. номер EINECS | 242-159-0 |
| SMILES | |
| InChI | |
| RTECS | XQ4000000 |
| ChEBI | 52991 |
| ChemSpider | 26988 |
| Безопасность | |
| ЛД50 | крысы, перорально 20 000 мг/кг |
| Токсичность | низкая |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нахождение в природе
правитьВ природе встречается минерал касситерит — SnO2, основная руда олова, который в чистом виде бесцветен, однако примеси придают ему самые различные цвета.
Получение
правитьСжигание олова в воздухе или в кислороде при высокой температуре:
- .
Окисление кислородом воздуха монооксида олова:
- .
Диспропорционирование при нагревании монооксида олова:
- .
Окисление олова горячей концентрированной азотной кислотой:
- .
Разложение сульфата олова при нагревании:
- ,
или взаимодействием сульфата олова(IV) с разбавленной щёлочью:
- .
Прокаливание на воздухе моносульфида олова:
- .
Физические свойства
правитьОксид олова(IV) из раствора при осаждении выделяется в виде гидрата переменного состава SnO2·nH2O, где так называемая α-модификация). При стоянии осадка переходит химически пассивную β-модификацию ( ). Соединения со стехиометрическим составом гидратов не выделены.
В воде практически нерастворим, рПР = 57,32. Нерастворим также в этаноле и других не взаимодействующих с веществом растворителях.
При высушивании гидрата диоксида олова образуется аморфный белый порошок с плотностью 7,036 г/см³, переходящий при нагревании в кристаллическую модификацию с плотностью 6,95 г/см³.
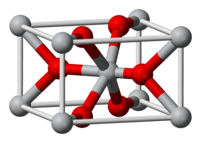
Оксид олова(IV) образует прозрачные бесцветные кристаллы тетрагональной сингонии, пространственная группа P 42/mnm, параметры ячейки a = 0,4718 нм, c = 0,3161 нм, Z = 2, — кристаллическая структура типа рутила (диоксида титана).
Молярная энтропия So
298 = 49,01 Дж/(моль·К). Теплоёмкость Co
p = 53,2 Дж/(моль·К). Стандартная энтальпия образования ΔHo
обр = −577,63 кДж/моль[1].
Является широкозонным полупроводником n-типа, при 300 К ширина запрещённой зоны 3,6 эВ, подвижность электронов 7 см2/(В·с), концентрация носителей 3,5·1014 см−3, удельное электрическое сопротивление 3,4·103 Ом·см. Легирование элементами V группы, например, сурьмой увеличивает электрическую проводимость на 3—5 порядков[1].
Диамагнитен. Молярная магнитная восприимчивость χmol = −4,1·10−5 моль−1[4].
Диоксид олова прозрачен в видимом свете, отражает инфракрасное излучение с длиной волны более 2000 нм[1].
Температура плавления 1630 °C[1]. При высокой температуре испаряется с разложением на монооксид олова (и его ди-, три- и тетрамеры) и кислород[1].
Химические свойства
правитьГидратированная форма переходит в кристаллическую при нагревании:
- .
Растворяется в концентрированных кислотах:
- .
При нагревании растворяется в разбавленных кислотах:
- .
Растворяется в растворах концентрированных щелочей:
- .
При сплавлении с щелочами и карбонатами образует метастаннаты:
- ,
а с оксидами щелочных металлов образует ортостаннаты:
- .
- ,
- .
Применение
править- В качестве катализатора
В сочетании с оксидами ванадия его используют в качестве катализатора для окисления ароматических соединений в синтезе карбоновых кислот и ангидридов кислот, катализатора реакций замещения и гидролиза.
- В датчиках газообразных горючих газов.
Плёнки из диоксида олова, нанесённые на стекло или керамику применяются в датчиках горючих газов в воздухе — метана, пропана, оксида углерода и других горючих газов. Нагретый до температуры в несколько сотен градусов Цельсия материал в присутствии горючих газов обратимо частично восстанавливается с изменением стехиометрического соотношения в сторону обеднения кислородом, что приводит к снижению электрического сопротивления плёнки[5]. Для применения в датчиках газа изучалось легирование диоксида олова различными соединениями, например, оксидом меди(II)[6].
- В электронной промышленности
Основное применение соединения для создания прозрачных токопроводящих плёнок в различных приборах — жидкокристаллических дисплеях, фотогальванических элементах и в других приборах. Нанесение плёнки вещества производится из газовой фазы разложением летучих соединений олова, для повышения электропроводности соединение обычно легируют сурьмой и соединениями фтора.
Также применяется для создания прозрачных проводящих обогревательных противообледенительных плёнок на стеклянной поверхности окон транспортных средств.
Применяется в материалах контактов электрических коммутационных аппаратов, например, серебряных контактов электромагнитных реле — в материал вводят Шаблон:Nobr2—14 % диоксида олова. Ранее для этой цели использовали весьма токсичный оксид кадмия.
Легирование кобальтом и марганцем дает материал, который можно использовать, например, в высоковольтных варисторах[7].
Легирование диоксида олова оксидами железа или марганца образует высокотемпературный ферромагнитный материал[8].
- В стекольной и керамической промышленности в качестве белого пигмента
Диоксид олова плохо растворяется в расплавленной силикатной или боросиликатной стекломассе и имеет высокий показатель преломления относительно силикатного связующего, поэтому его микрочастицы в составе стёкол рассеивают свет, придавая стеклянной массе молочно-белый цвет и используется в производстве матовых стёкол, глазурованной керамической настенной плитке, сантехнических фаянсовых изделиях и др.[9]
Изменяя состав стекломассы и технологию её приготовления можно изменять степень матовости продукта, так как растворимость диоксида олова увеличивается при повышении температуры обжига и увеличении концентрации в стекломассе оксидов щелочных металлов ( ) и оксида бора и снижается при увеличении содержания оксидов щелочноземельных металлов ( ), оксидов алюминия, цинка и свинца[10]. Чистый диоксид олова придаёт глазури белый цвет, который можно изменить добавлением оксидов других элементов, например, оксид ванадия придаёт глазури жёлтый цвет, хрома — розовый, сурьмы — серовато-синий[11].
- Покрытия на стекле
Тончайшие плёнки диоксида олова (~0,1 мкм) применяются в качестве адгезионного подслоя для нанесения на поверхность стеклянной посуды (в основном на бутылках, банках, сортовой посуде) полимерного покрытия, например, полиэтиленового. Нанесение таких тонких плёнок производится разложением на поверхности горячего стеклянного изделия летучих соединений олова, например, тетрахлорида олова или оловоорганических соединений, например, трихлорида бутилолова.
- В качестве абразивного материала
Микрокристаллы соединения имеют высокую твёрдость и применяется в составе полировальных паст и суспензий для полировки изделий из металлов, стекла, керамики, природных камней.
Безопасность
правитьСоединение малотоксично, ЛД50 для крыс 20 г/кг перорально. Пыль соединения вредно влияет на органы дыхания. Предельно допустимая концентрация пыли в воздухе производственных помещений 2 мг/м³.
Примечания
править- ↑ 1 2 3 4 5 6 7 8 9 10 Ковтуненко П. В., Нестерова И. Л. Олова оксиды // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 380—381. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- ↑ Pradyot, Patnaik. Handbook of Inorganic Chemicals (неопр.). — The McGraw-Hill Companies, Inc., 2003. — С. 940. — ISBN 0-07-049439-8.
- ↑ http://www.cdc.gov/niosh/npg/npgd0616.html
- ↑ CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — P. 4—147. — 2828 p. — ISBN 1420090844.
- ↑ Joseph Watson The stannic oxide semiconductor gas sensor in The Electrical engineering Handbook 3d Edition; Sensors Nanoscience Biomedical Engineering and Instruments ed R.C Dorf CRC Press Taylor and Francis ISBN 0-8493-7346-8
- ↑ Wang, Chun-Ming; Wang, Jin-Feng; Su, Wen-Bin. Microstructural Morphology and Electrical Properties of Copper- and Niobium-Doped Tin (IV) oxide Polycrystalline Varistors (англ.) // Journal of the American Ceramic Society[англ.] : journal. — 2006. — Vol. 89, no. 8. — P. 2502—2508. — doi:10.1111/j.1551-2916.2006.01076.x.[1] Архивная копия от 1 октября 2012 на Wayback Machine
- ↑ Dibb A.; Cilense M; Bueno P.R; Maniette Y.; Varela J.A.; Longo E. Evaluation of Rare Earth Oxides doping SnO2.(Co0.25,Mn0.75)O-based Varistor System (англ.) // Materials Research : journal. — 2006. — Vol. 9, no. 3. — P. 339—343. — doi:10.1590/S1516-14392006000300015.
- ↑ A. Punnoose; J. Hays; A. Thurber; M. H. Engelhard; R. K. Kukkadapu; C. Wang; V. Shutthanandan; S. Thevuthasan. Development of high-temperature ferromagnetism in SnO2 and paramagnetism in SnO by Fe doping (англ.) // Physical Review B : journal. — 2005. — Vol. 72, no. 8. — P. 054402. — doi:10.1103/PhysRevB.72.054402. Архивировано 23 сентября 2017 года.
- ↑ ’The Glazer’s Book’ — 2nd edition. A. B. Searle. The Technical Press Limited. London. 1935.
- ↑ ’Ceramic Glazes’ Third edition. C. W. Parmelee & C. G. Harman. Cahners Books, Boston, Massachusetts. 1973.
- ↑ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils, ed., Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5.
Литература
править- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
