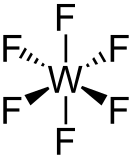
Фторид вольфрама(VI) (гексафторид вольфрама) — неорганическое соединение, соль металла вольфрама и плавиковой кислоты с формулой WF6, бесцветный газ или светло-жёлтая жидкость, реагирует с водой. Разрушает органические вещества, является сильным фторирующим агентом, очень ядовит.
| Фторид вольфрама(VI) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Фторид вольфрама(VI) | ||
| Традиционные названия | Фтористый вольфрам | ||
| Хим. формула | WF6 | ||
| Рац. формула | WF6 | ||
| Физические свойства | |||
| Состояние | бесцветный газ или светло-жёлтая жидкость | ||
| Молярная масса | 297,84 г/моль | ||
| Плотность |
газ 12,9 г/л ж. 3,44 кр. 3,990 г/см³ |
||
| Термические свойства | |||
| Температура | |||
| • плавления | 0,5; 2,0; 2,5 °C | ||
| • кипения | 17,3; 17,7; 19,5 °C | ||
| Мол. теплоёмк. | 120,5 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -1721,5 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в фтористом водороде | 13-5 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 7783-82-6 | ||
| PubChem | 522684 | ||
| Рег. номер EINECS | 232-029-1 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 455941 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м³ | ||
| Токсичность | высокотоксичен | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
править- Фторирование порошкообразного металлического вольфрама при комнатной температуре:
- Действие плавиковой кислоты на хлорид вольфрама(VI):
Физические свойства
правитьФторид вольфрама(VI) при нормальных условиях — это бесцветный газ, дымящий во влажном воздухе. При незначительном охлаждении конденсируется в светло-жёлтую жидкость.
При температуре 2°С образует кристаллы кубической сингонии, параметры ячейки a = 0,628 нм, Z = 2, плотность 3,99 г/см³.
При температуре −8,5°С происходит фазовый переход в ромбическую сингонию, пространственная группа P nma, параметры ячейки a = 0,9603 нм, b = 0,8713 нм, c = 0,5044 нм, Z = 4, плотность 4,75 г/см³ (-183°С).
Реагирует с водой, хорошо растворяется в перфторциклопентане, бензоле, диоксане и жидком фтористом водороде. С HF образует азеотропную смесь.
При охлаждении бензольного раствора до −78°С выпадают аддукты вида WF6•C6H6.
Химические свойства
править- Фторид вольфрама(VI) химически очень активен, является очень агрессивным фторирующим агентом, реагирует со стеклом и металлами, за исключением платины и золота.
- Реагирует с водой:
- С фторидами щелочных металлов образует комплексные соли:
Применение
править- При нанесении покрытий из вольфрама.
- Получение порошкообразного вольфрама.
- Для разделения изотопов вольфрама.
Биологическая роль и физиологическое воздействие
править- Гексафторид вольфрама WF6 токсичен; ПДК = 0,5 мг/м³ (в пересчёте на фтороводород HF).
Интересные сведения
правитьГексафторид вольфрама — самый тяжелый из известных газов при температуре +20 °C.
Литература
править- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.