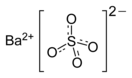
Сульфа́т ба́рия (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
| Сульфат бария | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Сульфат бария | ||
| Хим. формула | BaSO4 | ||
| Рац. формула | BaSO4 | ||
| Физические свойства | |||
| Состояние | твёрдый | ||
| Молярная масса | 233.43 г/моль | ||
| Плотность | 4.5 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 2876°F (1580°C) | ||
| • разложения | 2912±1°F (1600°C) | ||
| Давление пара | 0 Па[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде |
0,0002448 г/100 мл (20 °C) 0,000285 г/100 мл (30 °C) |
||
| Классификация | |||
| Рег. номер CAS | 7727-43-7 | ||
| PubChem | 24414, 517271 и 139207729 | ||
| Рег. номер EINECS | 231-784-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | CR0600000 | ||
| ChEBI | 133326 | ||
| ChemSpider | 22823 | ||
| Безопасность | |||
| Токсичность | не токсичен | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
правитьСульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
Последняя реакция используется также для получения пероксида водорода.
В промышленности большие объёмы сульфата бария получают из природного минерала тяжёлого шпата, при этом исходное сырьё измельчается и декантируется.
Свойства
правитьКристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C)[уточнить] и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Коэффициент преломления коллоидной частицы (дисперсной фазы) n = 1,63[прояснить].
Химические свойства
править- Сульфат бария нерастворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и иодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов[2].
- Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
- При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
- При температурах выше 1600 °C разлагается:
Токсичность
правитьСульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества. Однако стоит учесть, что в медицине используется фармакопейный сульфат бария, в котором гарантируется отсутствие токсичных примесей и возбудителей инфекций[3]. Промышленный сульфат бария может содержать токсичные для человека примеси. Применение сульфата бария, кустарно приготовленного из токсичного карбоната бария, послужило причиной человеческих жертв в инциденте с Целобаром[англ.] в Бразилии[4]. Следственный комитет Российской Федерации связывает смерти 7 пациентов в Санкт-Петербурге в период с декабря 2021 по январь 2022 с использованием при рентгенографии желудка промышленного сульфата бария[5].
Применение
правитьАналитическая химия
правитьВ аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
правитьЧасто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 % (массовая доля бария в BaSO4).
Пигмент-наполнитель
правитьСульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
- Смесь сульфата бария с сульфидом цинка, получаемая взаимодействием растворов сульфида бария и сульфата цинка, — литопон.
- Мелкокристаллический сульфат бария, получаемый осаждением сульфатом натрия из раствора сульфида бария, — бланфикс (фр. blanc fixe).
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода.
Другие применения
правитьСульфат бария используется для различных промышленных целей:
- В качестве наполнителя для фото- и писчей бумаги, для линолеума и для некоторых лако-красочных материалов. См., например, баритаж.
- Как белый наполнитель для пластмасс.
- В фотометрии: для окраски фотометрических шаров.
- В электрохимической промышленности при изготовлении свинцовых аккумуляторов как расширитель активной массы отрицательного электрода.
- При производстве пасты для травления стекла.
- При производстве некоторых огнеупорных материалов.
- Протектор для рентгеновского излучения (бариевая штукатурка рентгеновских кабинетов).
- Добавление в продукцию Lego для обеспечения рентгеноконтрастности на случай, если ребёнок проглотит деталь (это был эксперимент, который закончился неудачно в 1996 году, из-за снижения прочности деталей и токсичности сульфата бария промышленного качества).[6]
- Как основной компонент циммерита — обмазки брони немецких танков и САУ периода Второй мировой войны.
- В виде баритового концентрата при бурении скважин для утяжеления глинистых буровых растворов.
- В качестве белого пигмента при производстве бумаги.
Примечания
править- ↑ http://www.cdc.gov/niosh/npg/npgd0047.html
- ↑ Н. С. Фрумина, Н. Н. Горюнова, С. Н. Еременко. Аналитическая химия бария. — Москва: Наука, 1977.
- ↑ ФС.2.2.0001.15 Бария сульфат Архивная копия от 14 февраля 2022 на Wayback Machine — Pharmacopoeia.ru — сайт о регистрации лекарственных средств в России.
- ↑ Caso Celobar: diretores do laboratório fabricante do medicamento são condenados. Court Sentence Summary Архивная копия от 21 июля 2011 на Wayback Machine (in Portuguese) by JusBrasil Notícias Jurídicas, extracted from the Rio de Janeiro Court of Justice proceedings of January 30, 2009. Accessed on 2009-06-30.
- ↑ Проверка выявила смерть еще четырех пациентов после рентгена желудка в Петербурге. Таким образом число погибших увеличилось до семи Архивная копия от 5 февраля 2022 на Wayback Machine — ТАСС 2022
- ↑ Peter Eio, president of Lego Systems, Inc. To the Editor (англ.) // The New England Journal of Medicine. — Massachusetts Medical Society, 1996. — Vol. 334, no. 6. — P. 407. — ISSN 0028-4793. Архивировано 28 октября 2016 года.
Литература
править- Учебник общей химии Некрасов Б. В. 1981 год, в 2 томах.
Ссылки
править- Характеристики сульфата бария (аккумуляторного)
- Сульфат бария на медицинской энциклопедии (недоступная ссылка)